
НЕПУБЛИЧНОЕ АКЦИОНЕРНОЕ ОБЩЕСТВО "НВО ИММУНОТЕХ"
NON PUBLIC STOCK COMPANY "NVO IMMUNOTECH"
На рынке России и СНГ с 1992 года
Иммуноферментный анализ
(сокращённо ИФА) это лабораторный иммунологический метод
качественного или количественного определения различных соединений, макромолекул, вирусов и пр.,
в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса
проводят с использованием фермента в качестве метки для регистрации сигнала.
ИФА в настоящее время является широко распространенным методом в лабораторной диагностике для
определения различных биологически активных веществ в крови человека. Преимущества этого метода - высокая специфичность и чувствительность анализа, большой срок годности наборов, относительно недорогое оснащение лабораторий.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ИФА
Иммунохимические методы анализа, основанные на специфическом связывании определяемого соединения соответствующими антителами, широко вошли в аналитическую практику и используются в различных областях медицины, сельского хозяйства, микробиологической и пищевой промышленности, для целей охраны окружающей среды. Индикация образующегося комплекса антиген-антитело может быть осуществлена, если в один из исходных компонентов реакционной системы ввести метку, которая легко детектируется соответствующим высокочувствительным физико-химическим методом. Весьма удобными для этой цели оказались изотопные, ферментные, флуоресцентные, парамагнитные и др. метки, использование которых дало возможность увеличить чувствительность классических иммунохимических методов анализа в миллионы раз, а время анлиза уменьшить до нескольких минут.
Исторически первым среди них был радиоиммунологический анализ (РИА), предложенный в конце 50-х годов прошлого века. Благодаря возможности определять метку, которой являлся изотоп 125I, в очень малых концентрациях, удалось достигнуть высокой чувствительности анализа (на уровне пкг/мл). В середине 60-х годов для идентификации и локализации антигенов в гистохимических препаратах и выявления полос преципитации в иммунодиффузных и иммуноэлектрофоретических методах в качестве высокочувствительной метки было предложено использовать молекулы ферментов. Являясь по своей природе мощными химическими катализаторами, ферменты способны эффективно осуществлять наработку легко детектируемого продукта, что делает возможным определение ферментной метки в весьма малых концентрациях (до 10-12 М и ниже). На протяжении последних трех десятилетий иммуноферментные методы анализа интенсивно развивались как в теоретическом, так и практическом плане и к настоящему времени они сформировались в самостоятельное научное направление, имеющее важное прикладное значение. Наибольшее распространение получили гетерогенные методы иммуноферментного анализа, основанные на использовании полистирольных планшетов для иммобилизации антител или антигенов, специфическом связывании определяемого вещества на стенках лунок планшета и последующем выявлении образовавшихся иммунокомплексов с помощью меченных ферментами компонентов.
Структура и свойства антигенов и антител. Генетически чужеродные вещества, попадая в организм высших животных и человека, способны вызывать в них ряд специфических процессов, направленных на их удаление из организма. Система организма, выполняющая эту функцию, называется иммунной системой, а сами процессы – иммунологическими. К важнейшим из них следует отнести образование специфических белков крови – антител (иммуноглобулинов). Вещества, способные вызывать специфические иммунологические реакции в организме, получили название антигенов. Способность антигенов вызывать иммунный ответ называется иммуногенностью, а способность образовывать комплексы с антителами – антигенностью. К антигенам относятся белки, полисахариды, нуклеиновые кислоты как в очищенном виде, так и в виде компонентов различных биологических структур (клеток, тканей, вирусов и т.д.).
На поверхности молекулы сложного антигена можно выявить функциональные группы или остатки, обуславливающие антигенную специфичность, называемые антигенными детерминантами или эпитопами. Число эпитопов на поверхности сложной молекулы определяет валентность антигена. Понятие антигенная детерминанта включает в себя последовательность образующих ее химических функциональных групп и их пространственное расположение. В молекулах белков антигенная детерминанта образуется совокупностью аминокислотных остатков ( может варьировать от 5 до 20). Антигенные детериминанты белков бывают двух типов – секвенциальные, т.е. представляющие собой последовательность аминокислотных остатков в полипептидной цепи, и конформационные, образованные аминокислотными остатками из различных частей белковой глобулы. Во многих случаях единичная замена аминокислоты в структуре антигенной детерминанты или изменение конформации белковой глобулы являются достаточными для изменений антигенной специфичности макромолекулы. Если два антигена имеют только часть одинаковых антигенных детерминант, их называют перекрестно реагирующими антигенами.
Низкомолекулярные вещества, не способные сами вызывать образование антител, но приобретающие иммуногенные свойства после конъюгирования с высокомолекулярными носителями, например, бычьим сывороточным альбумином, называются гаптенами. К гаптенам относится широкий круг природных соединений: пептидные и стероидные гормоны, различные лекарственные препараты, антибиотики, витамины, олигосахариды и т.д.
Биологическая функция антител заключается в защите организма от проникновения чужеродных веществ путем образования прочных специфических иммунных комплексов с соответствующими антигенами и последующего удаления их из организма. Способность антител образовывать высокоспецифичные прочные иммунокомплексы с различными веществами и возможность получения антител в необходимых количествах являются основой иммунохимических методов анализа.
В организме антитела вырабатываются специфическими клетками крови - В-лимфоцитами, каждый из которых имеет на своей поверхности до 100 000 рецепторов одинаковой специфичности, способных узнавать любой чужеродный антиген. Антиген, встречаясь в кровотоке с комплементарным ему рецептором, проводит отбор (селекцию) соответствующего В-лимфоцита, который затем, трансформируясь в плазматическую клетку и многократно делясь, образует клон клеток. Каждый клон плазматических клеток секретирует гомогенные по своей структуре антитела. Однако так как антиген активирует в крови сразу большое количество типов В-лимфоцитов, которые содержат рецепторы различной степени специфичности по отношению к исходному антигену, такой иммунный ответ и антитела называются поликлональными. Сыворотку животного, содержащую специфические к данному антигену антитела, называютантисывороткой, при этом обычно указывают против какого антигена и каким животным она выработана (например, антисыворотка кролика против эритроцитов человека). Принципиально важным является то, что поликлональные антитела даже против одной-единственной антигенной детерминанты гетерогенны как по структуре активного центра, так и по физико-химическим свойствам. В том случае, если антиген поливалентен, например, белок, то в сыворотке крови образуются антитела, направленные против каждой индивидуальной антигенной детерминанты, что еще более усложняет состав антител.
В середине 70-х годов был разработан принципиально новый путь получения антител, основанный на слиянии (гибридизации) лимфоцитов иммунизированного животного с миеломными клетками с образованием новых клеток – гибридом. Особенностью таких клеток является их способность размножаться и продуцировать антитела в искусственных условиях вне организма. С помощью специальных методов клонирования можно выделить одну гибридную клетку, которая, размножаясь, будет секретировать в неограниченных количествах антитела только одного вида – моноклональные антитела, которые являются гомогенными как по специфичности, так и по физико-химическим свойствам.
Структура антител. Иммуноглобулины по своей химической структуре относятся к большому классу природных соединений – гликопротеидам, т.е. белкам, содержащим в своей структуре олигосахариды. Несмотря на огромное разнообразие антител и их гетерогенность, все они обладают некоторыми общими структурными элементами, обеспечивающими выполнение их основных функций.
По своим антигенным, эффекторным сфвойствам и структурным особенностям иммуноглобулины подразделяются на пять основных классов: IgA, IgD, IgE, IgG и IgM (Ig обозначаетиммуноглобулин).
Общей структурной единицей всех иммуноглобулинов является комплекс из четырех полипептидных цепей – двух идентичных между собой легких цепей с молекулярной массой 23 кД каждая ( L-цепи, от английского слова light- легкий) и тяжелых с молекулярной массой по 53000 (Н-цепи, от английского heavy- тяжелый). Каждая из легких цепей прочно соединена с NH2-концевыми участками тяжелых цепей благодаря наличию межцепочечных дисульфидных связей и множеству слабых гидрофобных, электростатических и других межатомных взаимодействий. Аналогичные связи существуют и между свободными участками тяжелых цепей. В целом структура такого комплекса напоминает латинскую букву Y (или Т) и характерна для иммуноглобулинов классов IgG, IgD, и IgE (рис.1).
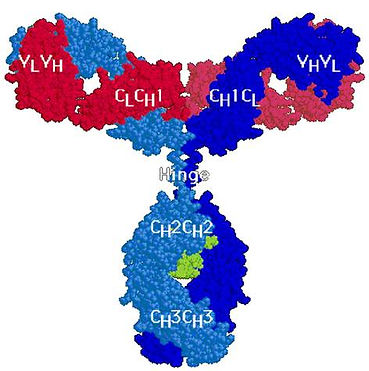
Рис.1. Пространственная структура молекулы IgG
При действии протеолитического фермента папаина молекула IgG распадается на три фрагмента, два из которых идентичны и сохраняют способность связывать антигены (так называемые Fab-фрагменты) и третий, способный к кристаллизации (Fc-фрагмент), отвечающий за эффекторную функцию антител (Рис.2). Другой протеолитический фермент пепсин разрывает пептидную связь, расположенную ближе к СООН-концу цепи от S-S связи между Н-цепями в Fc-фрагменте. В результате образуются так называемый рFc’-фрагмент, представляющий остатки тяжелых цепей и соединенные дисульфидными связями два Fab-фрагмента, обозначаемые как F(ab’)2-фрагмент.
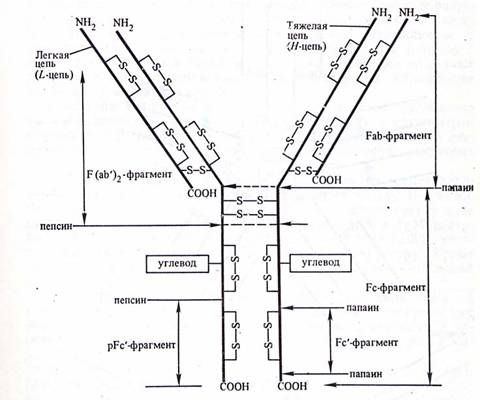
Рис.2. Схематическое изображение структуры молекулы IgG.
Антигенсвязывающий центр расположен в NH2-концевых частях Н- и L-цепей. Таким образом каждая молекула IgG, а также F(ab’)2-фрагменты содержат по два одинаковых антигенсвязывающих центра, а Fab-фрагмент – один.
Молекулы антител имеют большое число S-S –связей, которые можно разделить на 3 категории – межцепочечные, внутрицепочечные и связи между Н-цепями отдельных четырехцепочечных комплексов, обусловливающих образование полимерных молекул – IgM и IgА. Структура иммуноглобулинов различных классов обусловлена числом и расположение S-Sсвязей в молекулах, а также количеством четырехцепочечных элементов. IgМ присутствует в сыворотке в виде пентамера четырехцепочечных комплексов, соединенных S-S связями между Н-цепями. Некоторое количество IgА сыворотки также присутствует в виде димерной и тетрамерной формы (Рис. 3).
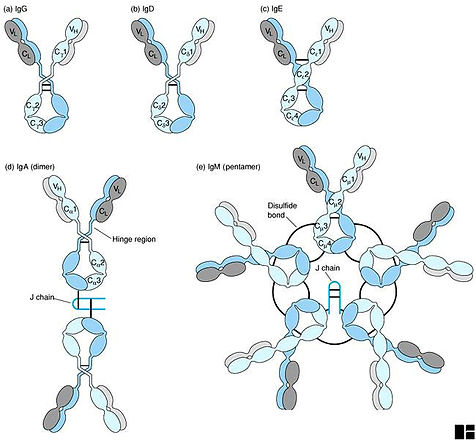
Рис.3. Схематическое изображение структуры молекул иммуноглобулинов различных классов
Легкие цепи иммуноглобулинов бывают только двух типов - l или c, и являются общими для всех пяти классов, в то время как тяжелые цепи обладают структурными, иммунологическими и химическими особенностями, характерными для каждого класса иммуноглобулинов. При исследовании аминокислотной последовательности было обнаружено, что все легкие и тяжелые цепи имеют одну принципиальную структурную особенность: они состоят из двух частей – вариабельной (V) и константной (С) (Рис.4).
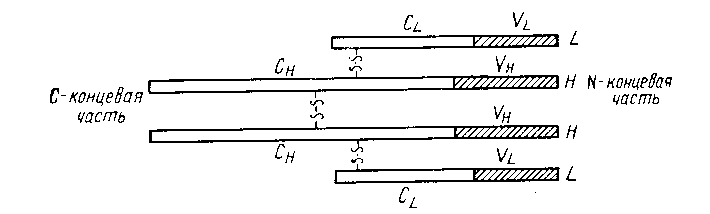
Рис.4. Схематическое изображение расположения константых и вариабельных участков в молекуле IgG.
Постоянная или константная часть легких цепей (СL) включает 107 аминокислотных остатков СООН-концевого участка, константная часть тяжелой цепи приблизительно в три раза (или в четыре в случае IgM и IgA) длиннее вариабельной. Оставшиеся последовательности аминокислотных остатков в NH2-концевой половине легких и тяжелых цепей образует так называемые вариабельные области (VC и VH). В каждой из легких цепей молекул антител существуют две внутрицепочечные дисульфидные связи, число такх связей в тяжелых цепях различно (4-6). Каждый из внутрицепочченых дисульфидных мостиков образует петлю из 55-70 аминокислотных остатков.
По данным рентгеноструктурного анализа, участки пептидных цепей вблизи петли образуют глобулярную структуру, в которую включается около 110 аминокислотных остатков (Рис.5). Такие глобулы в структуре молекул антител получили название доменов. NH2- концевой домен тяжелой цепи обозначают как VH, а три последующих в константной области тяжелой цепи – как СH1, СH2 и СH3 (для легкой цепи, соответственно VL и CL).
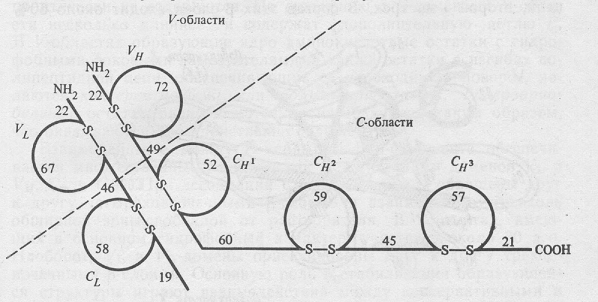
Рис.5. Схематическое изображение локализации доменных участков в легкой и тяжелых цепях иммуноглобулинов.
Связывание антигена происходит в доступной растворителю щели активного центра, образованной вариабельными доменами в NH2-концевой части легкой и тяжелой цепей. Способность связывать антигены с той же эффективностью, что и нативные молекулы антител, обладают Fab и F(ab’)2-фрагменты иммуноглобулинов. Основным принципом организации антигенсвязывающих центров иммуноглобулинов является полицентровая структура. Малые антигенные детерминанты связываются на ограниченном участке активного центра, комплементарном данной детерминанте. Большие детерминанты могут занимать практически всю область связывания.
Физико-химические закономерности взаимодействия антиген-антитело. Антитела, образуемые в ответ на введение в организм антигенов, специфически взаимодействуют с этими антигенами. В основе первичного взаимодействия лежат общие принципы любой бимолекулярной реакции. Так как в данном случае продуктом реакции является комплекс антиген-антитело, иммунная реакция является обратимой и описывается теми же кинетическими и термодинамическими параметрами, что и любой процесс комплексообразования.
k+1
Аг + Ат АгАт
k-1
Степень соответствия между антигенной детерминантой и антигенсвязывающей областью активного центра антитела (иммунологическая специфичность) определяется химической и пространственной комплементарностью, которая обусловлена, с одной стороны, взаимодействием электронных облаков реагирующих химических групп, с другой – стерическими силами отталкивания. С количественной стороны специфичность взаимодействия антиген-антитело характеризуется через аффинность антител или равновесную константу образования иммунокомплекса (Ка, размерность л/моль) или его распада (Кд = 1/Ka, размерность моль/л).
k+1
Ka =
k-1
Обычный диапазон изменения аффинности антител (Ка) составляет 105 – 1011 М-1. максимальные значения констант связывания характерны для антигенов, обладающих ярко выраженными гидрофобными свойствами или же взаимодействующих с активным центром антитела достаточно большой областью молекулы. Так как молекула антитела имеет два и более антигенсвязывающих центров, и кроме того, способна взаимодействовать с несколькими антигенными детерминантами молекулы антигена, реально существующий процесс взаимодействия поливалентного антитела с поливалентным антигеном является более сложным и характеризуется функциональной аффинностью или авидностью. С количественной точки зрения бивалентные взаимодействия являются почти на три порядка более прочными, чем моновалентные.
Трудность определения аффинности (или константы связывания антител) обусловлены следующими причинами: гетерогенностью антител по физико-химическим свойствам, в том числе, сродству к антигену, сложностью определения общего количества специфических антител, возможностью образования комплексов сложного состава в случае поливалентных антигенов. Однако для практических целей, в частности для целей использования в иммуноферментном анализе, достаточно знать эффективные значения, характеризующие суммарные свойства используемых антител. Для моноклональных антител определяемые значения констант аффинности носят истинные значения.
Все методы, позволяющие определять концентрации свободного и связанного антигена, можно условно разбить на две большие группы. К первой относятся методы, в которых стадия разделения свободного и связанного антигена осуществляется путем избирательного осаждения, аффинного связывания (иммобилизации) или гель-фильтрации. Для низкомолекулярных антигенов (гаптенов) используется равновесный диализ. Вторая группа включает методы, базирующиеся на изменении физико-химических свойств антигенов (или меток, связанных с антигеном) при комплексообразовании с антителами: тушении или усилении флуоресценции, изменении степени флуоресценции, ингибировании ферментативной активности.
Для количественного способа расчета констант комплексообразования реакции антиген-антитело наиболее распространенными являются способы, основанные на измерении равновесных концентраций комплекса при постоянной концентрации одного из реагентов и варьировании концентрации второго. В координатах Скэтчарда [АгАт]/[Аг] от [АгАт] (или B/F от B, В – bound, F –free) получаем прямую линию, тангенс угла наклона которой равен величине –Ка, а отрезок, отсекаемый на оси абсцисс- постоянную концентрацию одного из реагентов.
Образование комплекса антиген-антитело является обратимым процессом, т.е. равновесная константа связывания (аффинности) данного комплекса определяется отношением константы скорости ассоциации k1 к константе скорости диссоциации комплекса k-1. Значения константы скорости реакции ассоциации для большинства антигенов велики и приближаются к диффузионно контролируемому пределу до (108 М-1с-1). В случае белковых антигенов их значения приблизительно на два порядка меньше и варьируют от 105 до 5.106 М-1с-1. Наблюдаемые различия в аффинности антител обусловлены в основном, различиями в значениях константы скорости диссоциации (10-3 – 10-7 с-1).
Для экспериментального определения константы скорости ассоциации можно воспользоваться одним из следующих подходов: изучение начальных скоростей реакции при известных начальных концентрациях каждого из реагентов, изучение зависимости скорости образования продукта (комплекса) при избытке одного из реагентов и варьировании концентрации второго. Определение константы скорости диссоциации комплекса продят путем прямого измерения скорости процесса диссоциации комплекса в условиях его необратимости. Для этого используют один из следующих подходов.
1. После установления равновесия в системе проводят разбавление большим избытком буфера. При этих условиях (Vдисс >>Vасс) процесс диссоциации комплекса будет описываться экспоненциальной кривой, спрямление которой позволяет определить численное значение k-1.
2. В систему вводят вещества, способные быстро и полностью связывать или удалять свободный лиганд. Если скорость удаления свободного лиганда существенно больше скорости диссоциации комплекса, то наблюдаемая скорость распада комплекса описывается реакцией первого порядка и характеризуется константой k-1.
3. После установления равновесия в системе антитела-меченый антиген в нее водят избыток свободного немеченного антигена. В этих условиях процесс изменения концентрации комплекса меченый антиген-антитело описывается кинетикой первого порядка, константа скорости которого соответствует k-1.
Ферменты как метки в иммуноанализе. Принципиальная возможность применения ферментов в качестве меток в иммуноферментном анализе обусловлена чрезвычайно высокой чувствительностью регистрации ферментов в растворе. Известны усилительные системы, позволяющие регистрировать наличие всего нескольких сотен молекул ферментов в 1 мл раствора. Основными требованиями к молекулам ферментов для возможности их использования в качестве меток являются следующие: высокая удельная каталитическая активность, доступность, возможность получения фермента в высоко очищенном состоянии, сохранение каталитической активности после химической модификации при получении конъюгатов фермент-антитело (антиген), стабильность, простота и чувствительность метода определения концентрации (активности) фермента.
Наибольшее распространение в настоящее время среди ферментов получили пероксидаза хрена, щелочная фосфатаза. Для фотометрической регистрации активности пероксидазы предпочтительным в настоящее время является использование субстрата тетраметилбензидина. После остановки ферментативной реакции серной кислотой измеряют оптическую плотность раствора при длине волны 450 нм.
Методы иммуноферментного анализа. Первичным процессом в иммуноферментном (или иммунохимическом) анализе является стадия «узнавания» анализируемого соединения специфическим к нему антителом. Так как процесс образования иммунохимических комплексов происходит в строго количественном соотношении, обусловленном аффинностью, концентрациями компонентов и условиями реакции, то достаточным для определения исходной концентрации анализируемого соединения является количественная оценка образовавшихся иммунных комплексов. Для такой оценки возможно либо прямое определение концентрации образующихся иммунокомплексов (тип 1), либо количественная оценка оставшихся свободными мест специфического связывания (тип 2). Второй общей стадией любого метода иммуноферментного анализа является формирование связи меченного ферментом соединения со специфическим комплексом или свободными центрами связывания. И наконец, заключительным обязательным процессом в иммуноферментном анализе является трансформация ферментной метки в соответствующий сигнал, измеряемый каким-либо физико-химическим методом (спектрофотометрическим, флуориметрическим, люминесцентным и т.д.), что достигается путем измерения скорости превращения субстрата или количества продукта, образующегося за фиксированный промежуток времени.
Принимая во внимание вышеописанные подходы для определения специфических комплексов, дальнейшую классификацию методов иммуноферментного анализа, можно осуществить по типу реагентов, используемых на первой стадии анализа. Если на первой стадии в системе присутствуют только анализируемоле соединение и соответствующие ему центры связывания (антиген и специфические анатитела), то метод является неконкурентным. Для неконкурентного анализа типа 1 оптимальным является соотношение компонентов, при котором концентрация центров связывания значительно превышает концентрацию определяемого соединения. Необходимым условием для неконкурентного анализа типа 2 является соблюдение соотношения избытка или сравнимой концентрации определяемого соединения (антигена) и мест специфического связывания, так как в этом случае определяется разность общего числа мест связывания и числа образовавшихся иммунных комплексов. Если на первой стадии анализа в системе одновременно присутствуют анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за имеющиеся в относительном недостатке центры специфического связывания, то метод является конкурентным. Необходимым условием конкурентного метода является недостаток центров специфического связывания по отношению к суммарной концентрации анализируемого соединения и его аналога.
Следующим принципом классификации методов иммуноферментного анализа является их разделение по типу проводимых на каждой из иммунохимических стадий реакций. В соответствии с этим все методы можно разделить на две группы – гомогенные и гетерогенные.
Гетерогенные методы иммуноферментного анализа. Гетерогенный иммуноферментный анализ объединяет методы, в которых анализ проводится в двухфазной системе, при этом разделение на фазы может происходить на любой стадии определения. В целях удобства классификации целесообразно проводить разделение гетерогенных методов по характеру проведения первой стадии «узнавания», которая является определяющей для всего анализа. Если на первой стадии антиген или антитело используют в иммобилизованном состоянии и формирование специфического иммунокомплекса проходит на твердой фазе, то метод относится к твердофазным (англ. solid phase assay). Если же на первой стадии анализа образование специфических иммунных комплексов происходит в растворе, а лишь затем для целей разделения используют твердую фазу с иммобилизованным реагентом, то такие методы целесообразно классифицировать как гомогенно-гетерогенные.
Многообразие методов гетерогенного иммуноферментного анализа, относящихся к типам 1 и 2, обусловлено возможностью введения ферментной метки как в молекулу антигена, так и молекулу антитела. Кроме того, для конкретной схемы анализа определяющим является, какой из реагентов – антитело или антиген, использован в иммобилизованном виде для разделения иммунохимических комплексов от несвязавшихся компонентов.
В качестве примера гетерогенного неконкурентного метода проведения иммуноферментного анализа приведем одну из самых распространенных схем иммуноферментного анализа белков (поливалентных антиегенов), основанную на использовании пары антител различной антигенной специфичности, одно из которых иммобилизовано на поверхности твердого носителя, а второе конъюгировано с ферментной меткой (например, пероксидазой хрена). Анализ проводят следующим образом. В лунки полистирольного планшета с сорбированными антителами вносят анализируемый образец, инкубируют в течение 1 часа, при этом анализируемый антиген образует вступает в реакцию с антителами и образует иммунокомплекс на поверхности лунок. Планшет отмывают от несвязавшихся компонентов и добавляют меченные ферментом антитела. После вторичной инкубации и удаления избытка конъюгата антител с ферментом определяют ферментативную активность носителя, которая пропорциональна начальной концентрации исследуемого антигена. На стадии выявления специфического иммунокомплекса антиген оказывается как бы зажатым между молекулами иммобилизованных и меченых антител, что послужило поводом для широкого распространения в литературе названия «сэндвич»-метод (англ. sandwich). Часто в литературе встречается и другое название двухцентровой метод (англ. two-site assay). Схема может быть использована для анализа только тех антигенов, на поверхности которых существуют, по крайней мере две расположенные далеко друг от друга антигенные детерминанты, а для определения большого числа моновалентных антигенов (например, низкомолекулярные гормоны, лекарственные соединения, пестициды) метод неприемлем.
Конкурентный твердофазный анализ низкомолекулярных антигенов может быть реализован по следующей схеме. К иммобилизованным на носителе антителам добавляют раствор, содержащий анализируемый антиген и фиксированную концентрацию конъюгата антигена с ферментом. После проведения инкубации носитель отмывают от несвязавшихся свободного и меченого антигена и регистрируют ферментативную активность на носителе, которая обратно пропорциональна концентрации определяемого антигена.
Конкурентные твенрдофазные методы обладают меньшей чувствительностью по сравнению с неконкурентными. Предел обнаружения различных соединений для них ограничен как чувствительностью регистрации ферментной метки, так и аффинностью антител, в то время, как для неконкурентных методов, при отсутствии неспецифических взаимодействий, - только чувствительностью определения фермента. Поэтому для достижения высокой чувствительности анализа конкурентным методом необходимо использовать высокоаффинные антитела.
Гомогенные методы иммуноферментного анализа. К гомогенным относятся методы, осуществляемые в однофазной системе, и не требующие стадии механического разделения образовавшихся комплексов. Во всех схемах проведения гомогенного иммуноферментного анализа регистрируется концентрация не образующегося специфического комплекса антитело-антиген, а оставшихся свободными центров специфического связывания. Однако, в противоположность гетерогенным схемам, наблюдаемая ферментативная активность, соответствующая концентрации незанятых мест специфического связывания, может как уменьшаться, так и увеличиваться, что обусловлено различной природой воздействия связывания лигандов на ферментнативную активность. Введение метки в молекулу антигена является одним из наиболее распространенных подходов в гомогенных методах иммуноферментного анализа. Всегомогенные методы относятся к конкурентным и основаны на одновременном взаимодействии с антителами анализируемого и меченого антигенов. После образования в растворе соответствующего иммунохимического комплекса проводят измерение ферментативной активности, которая пропорциональна концентрации свободного или связанного меченого лиганда.
Одним из распространенных методов является EMIT-анализ (enzyme multiplied immunoassay technique), основанный на изменении активности ферментной метки в конъюгате фермент-антиген при образовании комплекса с антителами, происходящем в результате конформационных перестроек в молекуле фермента или стерическом исключении доступности молекулы субстрата к активному центру фермента при комплексообразовании конъюгата с антителами. Достоинствами гомогенных методов является значительное сокращение времени проведения анализа (несколько минут), недостатками – меньшая чувствительность и возможность влияния состава анализируемого образца на результаты анализа.
Перспективными направлениями дальнейшего развития иммуноферментного анализа является создание экспресс-методов, основанных на использованием мембранных и иммунохроматографических систем, проточно-инжекционных методов, кинетического анализа, иммунобиосенсорных устройств, позволяющих проводить экспресс-анализ, в том числе одновременное определение нескольких антигенов в одном образце, в реальном времени.
Литература
1. А.М.Егоров, А.П.Осипов и др. Теория и практика иммуноферментного анализа, М., Высш.шк., 1991

